Diagnostik und Therapie der kongenitalen Ichthyosen
Stand der Überarbeitung: 22.09.2020
von Prof. Dr. H. Traupe, Dr. Kira Süßmuth und Privatdozent Dr. V. Oji
Universitäts-Hautklinik
Von-Esmarch-Str. 58
48149 Münster
Tel.: 0251/83-56588
traupeh@ukmuenster.de
kira.suessmuth@ukmuenster.de
vinzenz.oji@ukmuenster.de
1.0 Einleitung und Krankheitsdefinition
Ichthyosen sind Störungen der Verhornung, die die gesamte oder doch überwiegende Hautoberfläche betreffen und auf Webfehlern (Mutationen) in den Erbanlagen (Genen) beruhen. Eine Reihe von Ichthyosen sind bereits bei Geburt vorhanden und werden deshalb als kongenital bezeichnet. Andere Ichthyosen entwickeln sich im 1. Lebensjahr und werden als „vulgäre“ oder auch einfache Ichthyosen bezeichnet. Von den vererbten Ichthyosen muss man solche Verhornungsstörungen abgrenzen, die erworben sind, wie z. B. die trockene Altershaut oder eine krankhaft trockene Haut, die im Rahmen von Ernährungsmangel-zuständen, z. B. bei einer sehr einseitigen, unausgeglichenen vegetarischen Ernährung entstehen können.
Die genetische Betrachtungsweise der Ichthyosen hat viel zum Verständnis dieser Krankheitsgruppe beigetragen. So weiß man heute, dass es bestimmte Anlagen (Gene) gibt, deren Produkte (Eiweiße/Proteine) ausschließlich in der Haut vorkommen. Wenn solch ein Gen eine Mutation aufweist, hat auch das betreffende Eiweiß einen Defekt oder es besteht ein Mangel an diesem Eiweiß. Die entstehende Hautkrankheit kann sich selbstverständlich dann auch nur an der Haut äußern. Es entsteht eine sogenannte nichtsyndromische Ichthyose, bei der „nur“ die Haut betroffen ist. Daneben gibt es aber auch Gene, die Aufgaben in mehreren Organsystemen haben. Die von diesen Genen gebildeten Eiweiße kommen dann nicht nur in der Haut, sondern z. B. auch in Knochen, in den Augen, in den Nerven und in anderen Geweben vor. Wenn ein Webfehler in einem solchen Gen auftritt, dann führt eine solche Mutation dazu, dass eben nicht nur die Haut, sondern auch andere Organe in Mitleidenschaft gezogen sind. Das Ergebnis ist dann eine sogenannte Syndrom-Ichthyose, wie sie beispielsweise bei dem sogenannten Netherton-Syndrom oder dem Conradi-Hünermann-Happle-Syndrom vorliegt. Wir können insofern zwei große Gruppen unterscheiden, einerseits die nichtsyndromischen kongenitalen Ichthyosen und andererseits die syndromischen kongenitalen Ichthyosen. Tabelle 1 gibt hierzu einen Überblick. Die etwas kryptisch anmutenden Abkürzungen, wie ABCA12 etc., beziehen sich auf die Namen der ursächlichen Gendefekte.
2.0 Nichtsyndromische kongenitale Ichthyosen
Die nichtsyndromischen kongenitalen Ichthyosen stellen eine Gruppe von Erkrankungen dar, die mehrere einzelne Ichthyosen umfassen. Die wichtigsten dieser Krankheiten werden im Folgenden besprochen.
| Tabelle 1 - Wichtige kongenitale Ichthyosen (Auswahl) | ||
|---|---|---|
| Nichtsyndromische kongenitale Ichthyosen | ||
| Harlekin-Baby | Autosomal-rezessiv | ABCA12 |
| Lamelläre Ichthyosis | Autosomal-dominant | ASPRV1 |
| autosomal rezessive kongenitale Ichthyosis (ARCI) | Autosomal-rezessiv | 1. Transglutaminase-1-Mangel/TGM1 (ca. 30-50%) 2. Lipoxygenasemutationen/ALOXE3 und ALOX12B 3. ABCA12-Mutationen 4. CERS3 5. CYP4F22 6. NIPAL4 7. PNPLA1 8. LIPN 9. SULT2B1 10. SDR9C7 |
| Epidermolytische Ichthyosis | Autosomal-dominant | Keratin-1- bzw. -10-Defekte |
| Superfizielle epidermolytische Ichthyosis | Autosomal-dominant | Keratin-2e-Defekt |
| Confetti-Ichthyosis | Autosomal dominant | Keratin 10-Defekt |
| Syndromale kongenitale Ichthyosen | ||
| Sjögren-Larsson-Syndrom | Autosomal-rezessiv | Defekte Fettaldehyddehydrogenase |
| PIBIDS- und Tay-Syndrom | Autosomal-rezessiv | Defekte DNA-Reparatur |
| Netherton-Syndrom | Autosomal-rezessiv | LEKTI-Mangel |
| Conradi-Hünermann-Happle-Syndrom | X-chromosomal-dominant | Cholesterinbiosynthesedefekt |
2.1 Harlekin-Ichthyosis
Die Harlekin-Ichthyosis wird heute als schwer verlaufende Sonderform der autosomal rezessiven kongenitalen Ichthyosis eingeordnet. Es handelt sich um eine sehr seltene und gleichzeitig extrem schwere Form einer angeborenen Ichthyose, wobei die Patienten bei der Geburt von einer panzerartigen Schuppung umgeben sind. Auch heute noch stirbt ein Teil der neugeborenen Kinder kurz nach der Geburt. Oft bestehen unmittelbar nach der Geburt Bewegungseinschränkungen. Diese erfordern eine zusätzliche Bewegungstherapie, um sogenannte Beugeversteifungen zu verhindern. Manchmal müssen Kinder mit diesem Krankheitsbild auch zeitweilig beatmet werden. Wenn die kritische Phase in den ersten Lebensmonaten überwunden ist, gestaltet sich die weitere Entwicklung aber günstiger, und die Ichthyose wird milder und beherrschbar. Sie geht klinisch in eine schwere lamelläre Ichthyose über. Die betroffenen Kinder weisen dabei allerdings neben sehr großen Schuppen eine ausgeprägte, die gesamte Haut erfassende Entzündung auf (sogenannte Erythrodermie).
Die Harlekin-Ichthyosis wird autosomal rezessiv vererbt. Für Eltern mit einem betroffenen Kind beträgt die Wahrscheinlichkeit, dass weitere Kinder erkranken, pro Schwangerschaft je 25%. Ursächlich besteht eine Störung in den sogenannten „lamellar bodies/Keratinosomen“. In diesen Strukturen werden in den Hautzellen vor allem Hautfette gespeichert, die beim Aufbau der Hornschicht benötigt werden. Das ursächliche Gen für die Harlekin-Ichthyose betrifft sogenannte nonsense Mutationen im ABCA12-Gen. Bemerkenswerter Weise lösen sogenannte missense Mutationen im ABCA12-Gen eine deutlich mildere ARCI-Form aus.
2.2 Weitere autosomal rezessive kongenitale Ichthyosen (ARCI)
Es bestehen weitere Formen der autosomal rezessiven kongenitalen Ichthyosen. Diese wurden früher auch als nicht Blasen bildende Ichthyosis congenita bezeichnet. Man weiß heute, dass es sowohl eine – recht seltene – autosomal dominant vererbte lamelläre Ichthyose gibt als auch die etwas häufigeren autosomal rezessiv vererbten Formen der kongenitalen Ichthyosis (ARCI). Die autosomal dominant vererbte lamelläre Ichthyosis ist unter anderem durch ausgeprägte Schuppenbildung an den Fußsohlen gekennzeichnet. Ursächlich liegen Mutationen im Gen ASPRV1 zugrunde, das am Abbau von Filaggrin beteiligt ist. Wenn eine Mutation in ASPRV1 vorliegt, wird das für die Haut so wichtige Schlüsseleiweiß Filaggrin unvollständig abgebaut und in der Hornschicht wird zu wenig Feuchtigkeit gespeichert. Diese Ichthyose ist sehr selten
Kinder mit einer autosomal rezessiv vererbten kongenitalen Ichthyose werden oft als sogenanntes Kollodium-Baby geboren, dabei ist die Haut von einer Membran umgeben, die sich aber innerhalb von 2 Wochen nach der Geburt von der Haut abstößt. Ein Teil der Patienten nimmt dann einen sehr guten Verlauf (ca. 10%) und entwickelt nur eine „Minimal-Ichthyosis“ oder heilt sogar völlig ab. Diese Form der ARCI wird auch als sogenanntes Selbstheilendes Kollodium-Baby oder als „self improving congenital Ichthyosis“ (SICI) bezeichnet. Bei dem anderen Teil der Patienten kann sich allerdings eine sehr schwere und dauerhafte lamelläre Ichthyosis oder auch schwere kongenitale Ichthyose aus der Gruppe der Syndrom-Ichthyosen entwickeln. Neugeborene mit einem Kollodiumbaby/einer Kollodiumhaut stellen einen medizinischen Notfall dar und werden deshalb in den ersten 2-4 Wochen ihres Lebens auf einer Neugeborenen-Intensivstation behandelt. Danach können die Kinder aber aus der Kinderklinik entlassen werden und die Eltern übernehmen die aufwändige Pflege.
Zurzeit geht man davon aus, dass es zumindest 10 verschiedene genetisch unterschiedliche Formen der autosomal rezessiven kongenitalen Ichthyosis (ARCI) gibt. Durch eine gene-panel-Diagnostik in spezialisierten Laboren wie dem Institut für Humangenetik der Universität Freiburg (Leitung Frau Prof. Fischer) können heute ca. 90% aller ARCI-Fälle genetisch aufgeklärt werden. Bei 10% bleibt die Ursache noch unklar.
Die häufigste Form beruht auf einer Mutation in einem Gen, das Transglutaminase-1 genannt wird und auf dem langen Arm von Chromosom 14 liegt. Dieser sogenannte Transglutaminase-Mangel kommt bei etwa 35% aller Patienten mit einer ARCI vor. Eine weitere, eher seltene Form beruht auf einem Gen, das auf dem langen Arm von Chromosom 2 liegt. Bei dieser Form liegt eine Mutation in dem Gen ABCA12 vor, das ein Transporteiweiß für Fette bildet. Dieser Defekt ist bei deutschen Familien recht selten. Eine dritte Form betrifft Mutationen in zwei eng benachbart auf dem kurzen Arm von Chromosom 17 liegenden Genen, die „Lipoxygenase“-Gene heißen und Aufgaben im Fettstoffwechsel der Oberhaut haben. Die Tabelle 1 listet weitere Gendefekte bei ARCI auf. Sehr viele der betroffenen ursächlichen Gene haben eine wichtige Rolle im Fettstoffwechsel der Haut bei der Ausbildung der Lipidschichen („cornified lipid envelope“) der Hornschicht.
2.3 Histochemische Testung der Transglutaminase-1 an der Haut
In der Vergangenheit spielte die histochemische Testung der Transglutaminase-1 in der Haut für die Diagnostik eine große Rolle. Heute wird dieses Verfahren fast nur noch für Forschungszwecke durchgeführt. Die molekulare Diagnostik, bei der aus einer Blutprobe gleichzeitig mehrere mögliche Gendefekte getestet werden (gene panel Diagnostik) hat die histochemische TG-1 Messung in der Haut verdrängt. Der Test ermöglicht aber ein biochemisches Verständnis der Erkrankung.
An unserer Klinik haben wir ein spezielles diagnostisches Verfahren entwickelt, den sogenannten histochemischen Transglutaminase-Nachweis, mit dem anhand einer Hautbiopsie (Hautprobe) an einem Gefrierschnitt festgestellt werden kann, ob ein Patient einen Transglutaminase-Mangel hat oder nicht. Dazu wird unter örtlicher Betäubung eine Hautprobe von wenigen mm Größe entnommen. Diese Biopsie wird zunächst in Stickstoff tiefgefroren und dann bei minus 80° Celsius aufbewahrt, damit später eine biochemische Analyse möglich ist. Hierfür werden kleinste Schnitte von der Probe angefertigt und auf einen Objektträger gebracht, der dann mit einem „Substrat“ für Transglutaminase überschichtet wird. Wenn die Transglutaminase in der Haut vorhanden und auch funktionstüchtig ist, erkennt man im Mikroskop (per Immunfluoreszenztechnik) ein Aufleuchten in den Hautschichten, die die Transglutaminase enthalten. Wenn das Substrat im Mikroskopbild nicht erscheint, bedeutet das also, dass die Transglutaminase fehlt oder defekt ist. Die stärkste Aktivität der Transglutaminase findet man in einer Schicht, die sich Körner-Schicht – Stratum granulosum – nennt und die unterhalb der Hornschicht liegt (Abb. 1).
Wir haben den Transglutaminase-Test inzwischen bei über 100 Patienten mit der ARCI durchgeführt und konnten bei ca. 35% einen Mangel der Transglutaminase finden. Die Aufgabe der Transglutaminase-1 ist der Aufbau eines speziellen Mantels, der die Hornzellen umgibt. Man spricht auch vom Aufbau eines verhornten Zellumschlages („cornified cell envelope“). Dieser verhornte Zellumschlag wird in der Körnerschicht aufgebaut und ersetzt in der Hornschicht die ursprüngliche Membran der Hautzellen. Der cornified envelope stabilisiert die Hornzellen und erlaubt eine bessere Verankerung der in der Hornschicht vorhandenen Fette mit den Hornzellen. Eine Vielzahl von Eiweißen münden in den cornified envelope ein oder sind hier verankert, so z. B. auch die Keratine und Eiweiße, die für Verankerungsstrukturen verantwortlich sind und als Corneodesmosomen bezeichnet werden.
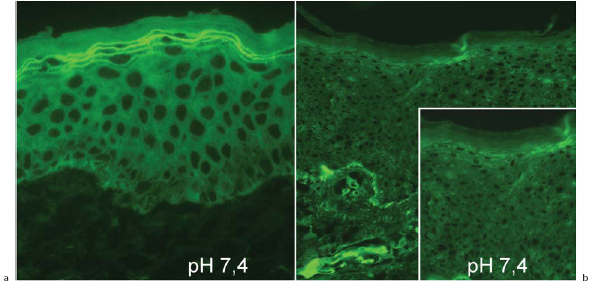
Abb. 1 Histochemischer Nachweis eines Transglutaminase-1-Mangels.
a) Normalhaut mit Aktivität in der Körnerschicht (Stratum granulosum)
b) Mangel der Transglutaminase-Aktivität
Das klinische Bild der kongenitalen Ichthyosen kann von einem vergleichsweise milden Befall, zum Teil auch gepaart mit einer deutlichen Entzündung, bis zu einem schweren Befall mit großen dunkelbraunen Schuppen variieren.
Als Fazit bleibt festzuhalten, dass man allein vom äußeren Bild der Haut her nicht sicher sagen kann, ob ein Betroffener mit ARCI einen Transglutaminase-Mangel hat. Zur Beantwortung dieser Frage sind weitere Untersuchungen wie der geschilderte histochemische Nachweis oder die Bestätigung durch eine gene panel DNA-Diagnostik notwendig.
2.4 Neue Wege in der Therapie des Transglutaminase-Mangels
Zum gegenwärtigen Zeitpunkt stellt die moderne Diagnostik im Wesentlichen einen Gewinn an Information über sich selbst und die eigene Krankheit dar. Für die Zukunft hoffen wir, dass man neue Wege in der Behandlung findet. Konkret wurde in Münster im Rahmen des Netzwerkes für Ichthyosen und verwandte Verhornungsstörungen (NIRK) und mit finanzieller Unterstützung sowohl des Bundesministeriums für Bildung und Forschung als auch des Selbsthilfe Ichthyose e. V. von Oktober 2003 bis Sommer 2013 ein Vorhaben durchgeführt, bei dem das normale funktionsfähige menschliche Gen der Transglutaminase in Insektenzellen eingeschleust wird und dann in diesen Zellen ein funktionsfähiges menschliches Transglutaminase-Eiweiß bildet (sogenannte rekombinante Expression). Auf diese Weise gelang es, die Transglutaminase-1 (TG1) in ausreichenden Mengen herzustellen und in sehr aufwändigen Untersuchungen experimentell bei Mäusen mit TG1-defizienter Ichthyose einen therapeutischen Effekt zu zeigen. Dafür erhielt die Universität Münster im Jahr 2013 von der EU eine sogenannte „Orphan drug designation“. Die Pharmaindustrie wollte das Verfahren aber bislang nicht übernehmen und weiterentwickeln, da die Herstellung der TG1 in Insektenzellen sehr teuer ist. Mit Unterstützung der SI und der italienischen Selbsthilfe UNITI und UFFI konnten wir vor kurzem die Forschungsarbeiten wieder aufnehmen und haben inzwischen ein humanes Herstellungssystem für die TG1 gefunden. In der Zellkultur zeigen sich ermutigende Effekte. Versuche mit Mäusen, die auf ihrem Rücken Transplantate humaner Ichthyosehaut tragen, sind für 2021 in Madrid geplant. Wir hoffen, so die Pharmaindustrie doch noch überzeugen zu können, das Projekt zu übernehmen (klinische Translation).
2.5 Die Blasen bildenden (bullösen) Ichthyosen
Eine weitere Gruppe der kongenitalen Ichthyosen kann mit einer Blasenbildung einhergehen. Es sind dies die bullösen bzw. epidermolytischen Ichthyosen. Auch hier kann das klinische Erscheinungsbild sehr schwanken. Während bei Geburt oder im 1. Lebensjahr häufig eine ganz massive Entzündung der Haut im Sinne der bereits angeführten Erythrodermie vorliegt, kann später die Entzündung zurückgehen, und es können dann stachelartige Schuppen und eine schuppende Verdickung der Haut das klinische Bild beherrschen. Gerade bei diesen Patienten ist die Entnahme von Hautproben sehr sinnvoll, da dabei charakteristische feingewebliche Veränderungen nachgewiesen werden können, nämlich der Befund einer sogenannten epidermolytischen Hyperkeratose.
Im Wesentlichen kann man heute 3 verschiedene Formen der bullösen Ichthyosen unterscheiden, nämlich einerseits die epidermolytische Ichthyosis - frühere Bezeichnung bullöse ichthyosiforme Erythrodermie, die nach dem französischen Arzt Brocq benannt wurde - und andererseits eine zumeist milder verlaufende Form, die superfizielle epidermolytische Ichthyose, die früher als Ichthyosis bullosa Siemens nach dem deutschen Hautarzt Siemens benannt wurde. Bei der schweren Form hat man Mutationen in bestimmten Eiweißen in den Hornzellen festgestellt. Es sind die Keratine, die der Laie auch von den Haaren kennt. In der Haut werden unter anderem die Keratine 1 und 10 hergestellt. Diese können Mutationen bei den schweren Formen der bullösen Ichthyosen aufweisen. Bei den leichteren Formen (Typ Siemens) konnte unter anderem bei Patienten aus Münster erstmalig festgestellt werden, dass hier Mutationen in einem anderen Keratin, das Keratin 2e heißt, ursächlich sind.
Eine dritte Form wird als Confetti-Ichthyose oder CRIE (congenitale retikuläre ichthyosiforme Erythrodermie) bezeichnet. Blasenbildung kommt bei dieser Form nicht vor. Im Vordergrund stehen die massive Rötung der Haut (Erythrodermie) und nach dem 3. Lebensjahr die Entwicklung vieler kleiner weißer Flecke, in denen sich die Ichthyose aufgrund von Rückmutationen fleckförmig zurückbildet, weshalb sie auch als Konfetti-Ichthyose bezeichnet wird. Ursächlich sind wiederum sehr spezielle Mutationen im Gen Keratin10 und gelegentlich Keratin 1. Leider ist auch die „rückmutierte“ Haut nicht so wie sie sein sollte.
2.6 Syndromale kongenitale Ichthyosen
Aus der Vielzahl der assoziierten kongenitalen Ichthyosen möchten wir auf 2 bestimmte Formen eingehen, nämlich das Conradi-Hünermann-Happle-Syndrom und das Netherton-Syndrom.
Das Conradi-Hünermann-Happle-Syndrom kommt nur bei Frauen vor, was daran liegt, dass betroffene Jungen schon in der Frühschwangerschaft sterben. Die betroffenen Mädchen weisen bei Geburt eine generelle Entzündung der Haut (Erythrodermie) auf, die sich aber innerhalb der ersten Monate zurückbildet. Neben der Ichthyosis sind auch andere Organsysteme, insbesondere die Knochen, betroffen. Hier kommt es zu einem frühen Zeitpunkt zu einer sogenannten Chondrodysplasia punctata, d. h. zu punktförmigen Verkalkungen in den Wachstumsfugen und damit auch zum Teil zu Asymmetrien im Knochensystem, wie z. B. einer einseitigen Beinlängenverkürzung oder auch zu Problemen mit der Hüfte usw. Außerdem weisen nach eigenen Untersuchungen viele Mädchen einen Minderwuchs auf, der aber relativ mild ist. Mit anderen Worten, die Mädchen sind etwa 20 cm kürzer als ihre gesunden Geschwister. Viele Mädchen haben Linsentrübungen (Katarakte), die oft auch einseitig oder sektoriell sind, d. h. nur einen Abschnitt des Auges betreffen. Die Ichthyosis ist typischerweise lineär, d. h. in Streifen angeordnet. Die übrige körperliche und geistige Entwicklung verläuft normal.
Das ursächliche Gen für diese Erkrankung liegt auf dem kurzen Arm des X-Chromosoms und heißt „Emopamil-bindendes Protein“ (EBP). In der Haut hat das Emopamil-bindende Protein wichtige Aufgaben in den letzten Schritten der Bildung von Cholesterin. Die Erkrankung muss deshalb als Bildungsstörung von Cholesterin aufgefasst werden. Im Blut lassen sich Cholesterinvorläuferprodukte nachweisen, die sich aufgrund des Enzymblocks anhäufen.
Ein biochemisch eng verwandtes Krankheitsbild stellt das sogenannte CHILD-Syndrom dar. Auch bei dieser Erkrankung kommt es zu Knochenveränderungen, z. B. Beinverkürzungen, und zu relativ umschriebenen Verhornungsstörungen auf der Haut. Das hier ursächliche Gen heißt NSDHL. Das entsprechende Gen wurde im Rahmen des von der Bundesregierung geförderten Ichthyose-Netzwerkes NIRK von den Partnern aus Marburg aufgeklärt.
2.7 Netherton-Syndrom
Kinder mit Netherton-Syndrom haben bei der Geburt eine sehr entzündete Haut (Erythrodermie). Bei einigen Kindern nimmt die Erkrankung einen milden Verlauf, und die Hautentzündungen bilden sich in den ersten Lebensmonaten deutlich zurück. Es entwickelt sich dann eine sogenannte Ichthyosis linearis circumflexa, die nur Teile des Körpers erfasst und bogige Hautveränderungen aufweist. Bei vielen Patienten bleibt aber die gesamte Haut betroffen, wobei sich auch dann die Entzündung der Haut mit höherem Lebensalter etwas bessert.
Diese Erkrankung betrifft auch die Haare, die brüchig sind, sich vor allem leicht ausziehen lassen und charakteristische Anomalien (Trichorrhexis invaginata/Bambushaar) aufweisen.
Assoziiert mit Netherton-Syndrom ist häufig eine Neigung zu Allergien, wie z. B. Asthma und Heuschnupfen. Bei den schweren Verlaufsformen kommt eine Gedeihstörung vor, die oft mit einer Wachstumsverzögerung und mit einer Enteropathie (Resorptionsstörung im Magen-Darm-Trakt für Nahrung) verbunden ist. Viele Kinder sind gefährdet für Hautinfekte, z. B. durch den Keim Staphylokokkus aureaus. Einige weisen auch schwere Immundefekte auf, an denen sie auch sterben können (z. B. Pseudomonas-Sepsis). Kritisch ist vor allem das erste Lebensjahr.
Die Hautbarriere ist bei Kindern mit Netherton-Syndrom in erheblichem Maße gestört, und es besteht ein deutlich erhöhter Wasserverlust über die Haut. Gerade bei Neugeborenen kann es hier zu kritischen Situationen (Austrocknen) kommen. Viele Kinder müssen deshalb als Neugeborene auf einer Intensivstation behandelt werden.
Das Netherton-Syndrom wird autosomal rezessiv vererbt. Ursächlich für die Erkrankung ist ein Mangel des Serin-Protease-Inhibitors LEKTI, der durch Mutationen im Gen SPINK5 hervorgerufen wird. Zu den Serin-Proteasen zählen eine Reihe von Enzymen wie z. B. Plasmin und Trypsin sowie weitere Trypsin ähnliche Enzyme in der Haut wie das sogenannte Stratum corneum Chymotrypsin-Enzym (Kallikrein). Serin-Proteasen können somit andere Eiweiße spalten. Man weiß heute, dass sie auch Verankerungsstrukturen zwischen den Hautzellen spalten können, die sogenannten Corneodesmosomen, und man vermutet, dass eine ungehemmte Aktivität dieser Enzyme bei Kindern mit Netherton-Syndrom in deren Haut zu einer Auflösung des Zusammenhaltes der Hornzellen in der Hornschicht führt, so dass die Hornschicht insgesamt auch sehr dünn wird. In der Tat weisen die Kinder mit Netherton-Syndrom mikroskopisch eine dünne Hornschicht auf, und die Schuppen sind bei ihnen meistens auch vergleichsweise fein.
Um die Ursache dieser Krankheit wirklich zu verstehen, muss man etwas um die Ecke denken. Es fehlt in der Haut ein Hemmstoff (LEKTI). Dadurch kommt es zu einer Balance-Störung und bestimmte andere Enzyme arbeiten dann zu heftig. Für die Diagnostik dieses Krankheitsbildes stehen in Münster und auch in vielen anderen Universitätsklinken in Deutschland gute Möglichkeiten zur Verfügung. So ist es möglich an Hautproben den Mangel des Hemmstoffes LEKTI in der Haut unmittelbar nachzuweisen (Abb. 2).
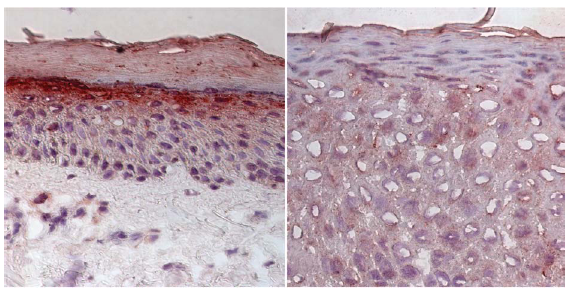
Abb. 2 LEKTI-Mangel bei Netherton-Syndrom.
a) Normalhaut mit Nachweis von LEKTI im Stratum granulosum.
b) Fehlen von LEKTI bei einem Patienten (aus Traupe 2005)
Funktionell kann beim Netherton-Syndrom das Enzym Kallikrein 5 nicht gehemmt werden. Es gibt Ansätze, neue Hemmstoffe von Kallikrein 5 als Salben zur Therapie einzusetzen. Bei Hunden gibt es dazu ermutigende Ergebnisse. Eine australische Biotec-Firma versucht zurzeit das Geld für eine klinische Prüfung beim Menschen am Kapitalmarkt einzuwerben. Eine andere Firma fokussiert auf ein etwas anderes Kallikrein. Wir haben die Hoffnung, dass es in absehbarer Zeit zu klinischen Prüfungen bei betroffenen Erkrankten kommt.
3.0 Therapie der Ichthyosen
3.1 Behandlung mit Salben
Die Hauptstütze jeglicher Therapie bei Ichthyosen stellt auch weiterhin die Behandlung mit Salben dar. Der ganz überwiegende Vorteil von Salben ist, dass sie einfach angewandt werden können und die meisten Salben keinerlei Nebenwirkungen haben, so dass auch eine lebenslange Anwendung bzw. eine Anwendung über sehr viele Jahre hinweg uneingeschränkt befürwortet werden kann. Viele nicht ganz so schwer ausgeprägte Formen von kongenitalen Ichthyosen können mit Salben recht gut behandelt werden, andererseits haben aber viele Betroffene auch die Erfahrung gemacht, dass eine Salbentherapie allein nicht ausreicht.
Der Zeitaufwand für die Pflege des eigenen Körpers von Patienten mit kongenitaler Ichthyosis ist in der Regel erheblich und in keiner Weise vergleichbar mit dem Zeitaufwand der Körperpflege von „Normalbürgern“. Zu bedenken ist auch, dass Textilien, die man trägt, häufiger und intensiver gewaschen werden müssen, und dass auch Gegenstände wie Waschmaschinen sich verständlicherweise schneller abnutzen. Im Dermatologen-Deutsch wird die Salbentherapie auch als lokale, d. h. örtliche oder „topische“ Therapie bezeichnet.
Was nicht?
An den Anfang möchten wir rücken, was man eigentlich besser vermeiden sollte, was zumindest problematisch ist. Dazu gehört die Anwendung von Salicylsäure. Salicylsäure ist in Konzentrationen von 5 - 10% sehr wohl wirksam, es gibt aber eine Reihe von Gesichtspunkten, warum man maximal 25% der Körperoberfläche mit einer salicylsäurehaltigen Salbe behandeln sollte. Es sind dies einerseits die akute Toxizität, d. h. die Giftigkeit, und andererseits die vermutete chronische Toxizität. Zur akuten Toxizität gibt es Fallberichte von Säuglingen, die bei mehrfacher Behandlung mit salicylhaltigen Salben am gesamten Körper unter anderem Schwindel, Ohrensausen und Luftnot entwickelt haben oder sogar gestorben sind. Letzteres ist natürlich die extreme Ausnahme. Ein Problem ist, dass bei vielen Kindern mit Ichthyosis die Haut sehr massiv entzündet ist und dadurch sowohl für die Salicylsäure als auch für andere Substanzen natürlich viel durchlässiger ist als die normale Haut (erhöhter transepidermaler Wasserverlust – siehe beispielsweise auch den Abschnitt dazu beim Netherton-Syndrom). Deshalb kann man nicht von der Situation ausgehen, die bei einer normalen Haut angetroffen wird.
Während auch heute noch bei der Krankheit Psoriasis (Schuppenflechte) in der Dermatologie routinemäßig und durchaus berechtigt Salicylsäure äußerlich angewandt wird, stellt sich die Situation bei Patienten mit Ichthyosis anders dar, da hier eben nicht nur 20 – 25% der Körperoberfläche von einer entzündeten Haut betroffen sind, sondern es oft so ist, dass die gesamte Haut eine Entzündung aufweist und dadurch dann sehr hohe Mengen der Salicylsäure aufgenommen werden.
Auch bei weniger ausgeprägter Entzündung ist die großflächige Anwendung von Salicylsäure problematisch. Wenn man davon ausgeht, dass ein Patient pro Tag 30 g Salbe benötigt und eine 10%-ige salicylsäurehaltige Salbe somit 3 g Salicylsäure enthält, würde bei einer Resorption von ca. 20% oder auch mehr wenigstens ein halbes bis ein Gramm Salicylsäure pro Tag aufgenommen werden. Die so entstehende Belastung für den Körper ist vergleichbar mit einer Dauerbelastung von 1 – 2 Tabletten Aspirin pro Tag. Bei einer solchen Belastung muss man davon ausgehen, dass es auf Dauer zu erheblichen Nebenwirkungen, z. B. an der Niere, kommt. Unseres Erachtens ist deshalb die Salicylsäure bei Ichthyose-Patienten lediglich für die Behandlung kleinerer Areale wie z. B. Handteller und Fußsohlen geeignet und für Neugeborene ganz sicher kontraindiziert.
Fazit: Wir raten von der Anwendung von Salicylsäure bei kongenitaler Ichthyose ab.
Was tun beim Neugeborenen?
Beim Neugeborenen und Säugling ist die Haut noch nicht völlig ausgereift und deshalb, ins-besondere wenn sie entzündet ist, für eine Reihe von Substanzen, z. B. auch für Harnstoff, sehr viel durchlässiger als bei älteren Kindern und Erwachsenen. Überdies ist die Körperoberfläche des Neugeborenen bezogen auf sein Gewicht um den Faktor 2,4-mal größer als die Körperoberfläche eines Erwachsenen.
Bei Neugeborenen empfehlen wir deshalb zunächst einmal die Anwendung von reinen Pflegesalben/Markensalben (z. B. Linolafett®, Bepanthen®, Neribas®-Salbe). Patienten haben uns mitgeteilt, dass sie bei ihren neugeborenen Kindern gute Erfahrungen mit der Kombination von Linolafett und dem Vitamin-E-Präparat Optovit® gemacht haben. Grundsätzlich ist es so, dass gerade in der Salbentherapie auch einmal verschiedene Grundlagen ausgetestet werden können und sollten, um individuell herauszufinden, womit man am besten auskommt.
Eine Harnstoffbehandlung ist bei Neugeborenen problematisch, sofern der gesamte Körper behandelt werden soll. Auch hier sind vereinzelt Berichte über Vergiftungserscheinungen erschienen, wobei die Intoxikationen aber milder waren als bei den Salicylsäure-Vergiftungen. Gemäß der medizinischen Leitlinie, an deren Erarbeitung auch die SI beteiligt war, sollte eine Harnstoffbehandlung erst nach dem 1. Lebensjahr beginnen.
Was ist Standard bei Kleinkindern und Erwachsenen?
Seit langer Zeit erprobt sind Kochsalzsalben, die bis zu 10% Kochsalz enthalten, harnstoffhaltige Salben, ebenfalls mit einem Anteil von bis zu 10% Harnstoff, und milchsäurehaltige Salbe, die ebenfalls bis zu 10% Wirkstoff enthalten.
Zum Kochsalz
Viele Patienten kennen aus eigener Erfahrung die gute Wirkung eines Bades im Mittelmeer und eines anschließenden Aufenthaltes in der Sonne. Auch das Baden im Salzwasser in der Nordsee kann hilfreich sein, genauso wie ein Aufenthalt bereits an der Nordsee aus Gründen des hohen Salzgehaltes der Luft häufig hilft. Diese Effekte waren auch schon früher bekannt, und von daher hat die Salzbehandlung eine lange Tradition. Um Salzbäder herzustellen, die effektiv sind, bedarf es aber wenigstens einer 3%-igen Salzkonzentration, d. h. dass bei 150 Liter Volumen Badewasser pro Badewanne 4,5 kg Salz dem Bad beigefügt werden müssen. Dies ist für die allermeisten Patienten schon aus technischen Gründen nicht durchführbar und kann auch zu Korrosionseffekten an den Leitungen führen. Allerdings lässt sich für umschriebene Zeiträume, z. B. im Rahmen eines Klinikaufenthaltes in einer Reha-Klinik, eine sogenannte Balneo-Photo-Therapie, bei der gebadet wird und anschließend mit UV-Licht behandelt wird, durchaus durchführen. Diese Balneo-Photo-Therapie wird in vielen Rehabilitationskliniken angeboten. In Münster führen wir keine Balneo-Photo-Therapie bei Patienten mit Ichthyose durch.
Mit dem Lösen von Kochsalz in Salbe haben wir bei der Rezeptur von Salben in der ambulanten Therapie eher schlechte Erfahrungen gemacht. Eine Reihe von Patienten haben berichtet, dass sie damit nicht zufrieden waren und das Gefühl hatten, dass das Salz auskristallisiert und unangenehm auf der Haut reibt.
Andererseits habe ich von anderen Betroffenen gehört, dass ihre Erfahrungen wesentlich besser waren. Offensichtlich kommt es darauf an, wie der Apotheker das Salz löst und dann in die Salbe einarbeitet. Ein guter Trick scheint zu sein, zunächst in einem kleinen Volumen Wasser, z. B. 20 – 40 ml, das Salz zu lösen, dann die Salbe etwas zu erwärmen und das gelöste Wasser in die etwas erwärmte Salbe einzuarbeiten. Insbesondere die in Münster gern eingesetzte Basisgrundlage mit dem Namen Unguentum Cordes® lässt sich nach Erwärmung besser verarbeiten und auch besser aufstreichen. Für die Streichfähigkeit der Unguentum Cordes-Salbe ist auch der Wasseranteil dieser Salbe von Bedeutung, wir fügen meistens einen 20%-igen Wasseranteil zu. Sinnvoll ist es, dass die Unguentum Cordes-Salbe sodann im Kühlschrank aufbewahrt wird, die täglich anzuwendende Menge aber kurz vor dem Auftragen herausgenommen wird und beispielsweise auf der Heizung oder in der Hand erwärmt wird.
Es lässt sich somit festhalten, dass sich Salzsalben durchaus angenehm auf der Haut anfühlen können und häufig auch den Effekt haben, dass sich die Haut „optisch“ glättet, also weniger schuppig erscheint. Der schuppenlösende („keratolytische“) Effekt ist aber geringer als bei harnstoff- und milchsäurehaltigen Präparaten.
Zur Vitamin-A-Säure
Ein Zusatz, der recht effektiv ist, ist die Vitamin-A-Säure. Die Benutzung von Vitamin-A-Säure in Konzentrationen von 0,03% - 0,1% wurde erstmalig im Jahre 1962 von Prof. Stüttgen eingeführt. Er konnte nachweisen, dass die örtliche Anwendung von Vitamin-A-Säure recht effektiv sein kann, allerdings ist Vitamin-A-Säure sehr häufig auch hautreizend. Für Patienten mit sehr entzündlichen Verlaufsformen, d. h., wenn die Haut sehr gerötet ist, ist Vitamin-A-Säure daher nicht geeignet. Als Handelspräparat gibt es z. B. das Präparat VAS-Carbamid-Widmer®. Wir wenden dieses Präparat bei Problemzonen an, z. B. wenn man im Halsbereich oder auch auf der Stirn eine dicke Schuppung hat und diese lösen möchte. Man kann sich auch dazu entscheiden, nicht jeden Tag mit der Vitamin-A-Säure-haltigen Salbe zu behandeln, sondern z. B. nur jeden zweiten oder jeden dritten Tag. Damit lassen sich die Hautreizungen meistens doch vermeiden. An den anderen Tagen kann man dann eine harnstoffhaltige Creme oder eine pflegende Salbe anwenden.
Zum Harnstoff
Die Behandlung mit Harnstoff geht auf Prof. Swanbeck, einem Dermatologen aus Schweden, zurück und wurde von ihm 1968 erstmalig angewandt. Heute ist die Harnstoffbehandlung eine sehr bewährte Standard-Therapie, wobei man allerdings sagen muss, dass Harnstoff bei Hautverletzungen auch reizend sein kann, insbesondere, wenn mehr als 5% verwandt wird. Viele Kindern erwähnen, dass Harnstoffpräparate auf der Haut „brennen“ und ihnen nicht angenehm sind. Auch Patienten mit sehr entzündlichen Ichthyoseformen, bei denen die Haut stärker gerötet ist, vertragen Harnstoff schlecht. Hier kommen Glycerin-haltige Salben wie Dexeryl®- Creme infrage. Harnstoff „hydratisiert“ die Epidermis, da er Wasser bindet. Die Haut wird sozusagen „gewässert“. Er ist außerdem zellteilungshemmend und kann Eiweiße (Proteine) auflösen („keratolytischer Effekt“). Die Wirkung von Harnstoff kann noch gesteigert werden, wenn man z. B. Milchsäure oder auch Kochsalz damit kombiniert. Eine in Münster üblicherweise verwandte Rezeptur sieht wie folgt aus:
Urea pura 20,0
Aqua dest. 40,0
Ung. Cordes auf 200,0
Der in dieser Salbe vorgegebene Wasseranteil von 20% lässt sich auch auf 40% steigern, was die Streichfähigkeit etwas verbessert.
Zur Milchsäure
Die Behandlung mit Milchsäure wurde 1974 von van Scott und Yu in die Behandlung der Ichthyosen eingeführt und wird in den USA sehr gerne durchgeführt. Auch Milchsäure kann sehr reizend sein und weist eine Reihe weiterer „galenischer“ Probleme auf. Die Herstellung von Milchsäure-haltigen Salben ist leider nicht trivial. Milchsäure lässt sich, wie bereits erwähnt, auch mit Harnstoff kombinieren, wobei wir dann dazu raten, eine 10%-ige Harnstoffkonzentration nicht zu überschreiten und nicht mit mehr als 5% Milchsäure zu kombinieren. Auch sehr viele Fertigpräparate enthalten beide Wirkstoffe, da Milchsäure gleichzeitig als Konservierungsmittel in Salben wirkt.
Sowohl für die Behandlung mit Milchsäure als auch mit Harnstoff ist zu bedenken, dass auch hier die Salbengrundlage eine wichtige Rolle spielt. Generell gilt – mit wenigen Ausnahmen -, dass Salben Fettgrundlagen sind, aus denen heraus der Harnstoff eine größere Tiefenwirkung hat, wenn er auf die Haut aufgebracht wird. Cremes enthalten hingegen mehr Wasser, lassen sich somit besser auftragen, aber die Tiefenwirkung der eingemengten Präparate ist nicht ganz so groß. Letzteres lässt sich auch über die sogenannten Lotionen, die Harnstoff enthalten, sagen.
Zu Vitamin-D-haltigen Salben
Vitamin-D-haltige Salben, die unter anderem die Substanzen Calcipotriol und Calcitriol enthalten, wie sie z. B. in Psorcutan® oder Curatoderm® vorhanden sind, werden bei Patienten mit Psoriasis und auch bei Kindern mit Psoriasis angewandt. Allerdings muss hier einschränkend gesagt werden, dass für diese Präparate eine Behandlung des gesamten Körpers nicht in Frage kommt, da sie dafür nicht zugelassen sind und es bei einer Ganzkörperbehandlung eventuell zu einer Verkalkung z. B. in der Niere kommen kann. Vitamin-D-haltige Salben können deshalb nur auf kleinen Flächen, maximal einem Drittel der Körperoberfläche, bei Patienten mit kongenitalen Ichthyosen angewandt werden. Die Wirkung dieser Salben ist möglicherweise auch zum Teil von der Form der Ichthyose abhängig.
Zum Polyäthylenglykol (Macrogol)
Zu dieser Behandlungsform wurden wir in den Jahren 2003-2009 durch die Arbeitsgruppe von Prof. Küster in Bad Salzschlirf angeregt, die sehr positive Erfahrungen bei Patienten gemacht hat, die bei schwerem Kopfbefall Polyäthylenglykol Charge 400 unverdünnt erhalten hatten. Polyäthylenglykol hat eine keratolytische Wirkung, die auf Eiweiß-denaturierenden Eigenschaften dieser Substanz beruhen. Unverdünnt ist Polyäthylenglykol allerdings sehr flüssig und meines Erachtens für den Körper als Salbengrundlage nicht geeignet. Hingegen ist am Kopf eine flüssige und damit leicht auftragbare Grundlage durchaus erwünscht. Chemisch gesehen handelt es sich bei Polyäthylenglykol um ein „Polymer“ von Äthylenoxid, das vielen kosmetischen Produkten beigesetzt ist. Die Bezeichnung „400“ bezieht sich auf das Molekulargewicht. Polyäthylenglykol ist für die Haut untoxisch und reizt nicht. Kollegen aus der Pädiatrie haben allerdings kritisiert, dass auch Macrogol ins Blut aufgenommen werden kann und „hyperosmolar“ wirken kann – also das Blut „dickflüssiger“ machen kann. Im klinischen Alltag haben wir bislang aber keine negativen Erfahrungen gemacht.
In den letzten Jahren haben wir bei vielen Patienten einen 20%-igen Zusatz von Polyäthylenglykol der Charge (Molekulargewicht) 400 benutzt und z. B. gemeinsam mit 20% Wasser in die von uns routinemäßig eingesetzte Salbengrundlage Unguentum Cordes einmengen lassen. Nach unserer Erfahrung kommt der Effekt einer solchen Polyäthylenglykolhaltigen Salbe durchaus der Behandlung mit einem 5%-igen Harnstoffzusatz gleich. Die Polyäthylenglykolhaltige Salbe hat aber den entscheidenden Vorteil, dass sie auf der Haut nicht „brennt“. Eine in Münster oft verwandte Rezeptur sieht wie folgt aus:
Polyäthylenglycol Charge 400 40,0 Aqua dest 40,0 Ung. Cordes auf 200,0g
Zu beachten ist allerdings, dass diese Creme nach dem 12. Lebensjahr nur mit einem zusätzlichen Urea-Anteil von 5 % über die gesetzlichen Krankenkassen erstattungsfähig ist.
Zu Glycerin
Auch Glycerin ist hydratisierend und wird in Salben mit etwa 15% angewandt. Es gilt als untoxisch und wird besser als Harnstoff auf der Haut toleriert. Ein Fertigprodukt ist Dexeryl®-Creme.
Zu Bädern
Tägliche Bäder helfen vielen Patienten mit kongenitalen Ichthyosen erheblich und werden zum Teil als Reinigungsbad, zum Teil auch mit dem Zusatz von Kochsalz, Badeöl oder Backpulver durchgeführt. Bei den Bädern wird die Haut aufgeweicht, und man kann dann manuell mit diversen Hilfsmitteln die Haut abbürsten und so eine mechanische Schuppenentfernung im Bad durchführen. Gleichzeitig dienen die Bäder dazu, Salbenreste, Schuppen und Bakterien von der Haut zu entfernen. Wenn man einen Badeölzusatz hinzufügen möchte, dann empfiehlt es sich, ein spreitendes Ölbad zu benutzen wie z. B. das Handelspräparat Balmandolöl®. Dieses Öl lässt sich auch pur auf die Haut auftragen – beispielsweise nach dem Bad. Bei einem Ölbad ist es wichtig, dass beim Trocknen der Ölfilm nicht wieder von der Haut „abgerubbelt“ wird. Es kann deshalb eine Überlegung wert sein, zunächst ein tägliches Reinigungsbad mit der mechanischen Schuppenentfernung durchzuführen und erst danach ein Öl aufzutragen. Kontraproduktiv sind Schaumbäder, da sie zu einer Verletzung des Lipidhautfilmes führen. Allerdings verzichten viele Betroffene auf Ölbäder, da man in der Badewanne auf einem Ölfilm leicht ausrutschen kann und beim Abtrocknen der Ölfilm von der Haut wieder entfernt wird und im Handtuch landet.
Aus Unkenntnis raten viele Hautfachärzte Patienten mit Verhornungsstörungen von einem täglichen Bad ab, weil sie meinen, dass damit das Problem der trockenen Haut noch verstärkt würde. Dem ist aber nicht so, sondern es reicht aus, sich von Schaumbädern und allzu viel Duschgelen fern zu halten. Der tägliche Kontakt mit Wasser ist für die Haut kein Problem, wenn entsprechend nachgefettet wird.
Backpulver bzw. Natriumbikarbonat als Badezusatz
Viele Mitglieder der Selbsthilfegruppe haben uns geradezu „euphorisch“ darüber berichtet, dass sie 2 – 3-mal die Woche ihrem Reinigungsbad Backpulver, bzw. Natriumbikarbonat (etwa 6g pro Liter, so dass das Wasser sich schmierig anfühlt) beimengen, und dass dies einen stark schuppenlösenden, wenngleich zum Teil die Haut auch etwas belastenden Effekt hat. In der AWMF-Leitlinie wird inzwischen diese Behandlungsform empfohlen, allerdings kann die Rezeptur von Natriumbikarbonat zu Lasten der GKV Probleme bereiten.
Zur Dampfsauna
In der Selbsthilfe wurde ebenfalls die Idee geboren, mit Hilfe einer Dampfsauna das Hautbild bei Ichthyosis günstig zu beeinflussen. Allerdings ist der Einbau einer Dampfsauna ins eigene Heim nicht gerade billig, und man sollte vorher ausprobieren, ob diese Methode einem wirklich hilft und angenehm ist. Konzeptionell betrachtet führt eine Dampfsauna-Behandlung zu einer hohen Luftfeuchtigkeit und kann auf diese Weise sowohl die Hornschicht als auch die darunterliegenden Schichten der Epidermis „hydratisieren“ und so das Wirkprinzip von Harnstoff nachahmen.
3.2 Innerliche Behandlung mit Retinoiden
Die innerliche oder systemische Therapie mit Retinoiden (d. h. Abkömmlingen der Vitamin-A-Säure) wurde bei Patienten mit Ichthyosen etwa ab 1977 in der Schweiz und in Deutschland begonnen. Es gibt also einige Patienten, die bereits seit mehr als 40 Jahren mit dieser Therapie ihre persönlichen Erfahrungen gesammelt haben.
Für die Behandlung mit Vitamin-A-Säure-Präparaten wird in Deutschland im Wesentlichen das Präparat Neotigason® (Wirkstoff Acitretin) verwandt. Es hat eine Reihe von Wirkungen, die direkt über den Zellkern vermittelt werden. Durch dieses Präparat wird eine Vielzahl von Genen beeinflusst, aber es findet keine spezifische Korrektur einer genetischen Störung statt. Insofern handelt es sich bei der Therapie mit Neotigason oder mit einem anderen Retinoid immer um eine symptomatische oder symptomunterdrückende Behandlung, ähnlich wie das natürlich auch für die Salbentherapie gilt. Entwickelt wurden die Retinoide ursprünglich, um Patienten mit Schuppenflechte (Psoriasis) oder Akne zu behandeln. Man hat dann erst festgestellt, dass auch Patienten mit Ichthyosis gut davon profitieren. Ziel einer Retinoidtherapie sollte es allerdings nicht sein, die Salbenbehandlung überflüssig zu machen, sondern diese auf sinnvolle Weise zu ergänzen.
Bevor man eine Therapie beginnt, muss man bei Retinoiden Labor- und eine Reihe von Röntgenuntersuchungen veranlassen, um eine Wachstumsstörung auszuschließen. Während der Therapie sind ggf. weitere Röntgenkontrollen notwendig, insbesondere bei Beschwerden am Skelettsystem. Als übliche Dosierung wird bei Neotigason allgemein 0,5 mg/kg Körpergewicht empfohlen, allerdings ist eine individuelle Anpassung der Dosis erforderlich. Im Verlauf einer Langzeittherapie – angelegt auf länger als 1 Jahr – sollte man immer anstreben, gleichzeitig eine Salbenbehandlung durchzuführen, um so die Gesamtdosis (kumulative Effekte) der Retinoide niedrig zu halten. Zu bedenken ist, dass auch bei einer Langzeittherapie wenigstens alle 3 Monate Laborkontrollen durchgeführt werden sollten. Hier müssen sowohl die Leberwerte als auch die Fettwerte und das Blutbild kontrolliert werden. Das Präparat kann bei einigen Patienten dazu führen, dass das Cholesterin und die sogenannten Triglyzeride ansteigen.
Unter der Behandlung mit Retinoiden gibt es eine Reihe von subjektiv unangenehmen Nebenwirkungen, die aber zumeist tolerierbar und beherrschbar sind. Dazu zählen unter anderem, dass die Lippen trocken werden können (Lippenentzündung). Sowohl die Nasenschleimhaut als auch die Augenschleimhaut können auffällig trocken werden. Diese Nebenwirkungen lassen sich durch entsprechende Gegenmaßnahmen wie z. B. die Anwendung von Lippenstiften, Nasenöl und Augentropfen in der Regel gut in den Griff bekommen und sind zum Teil auch dosisabhängig.
Einige Patienten entwickeln unter dem Medikament auch Kopfschmerzen, was Ausdruck eines erhöhten Hirndruckes nach der Einnahme von Retinoiden sein kann. In den allermeisten Fällen legen sich die Kopfschmerzen nach einer Weile der Einnahme wieder von selbst. Wenn sie sehr massiv sind, kann man aber gezwungen sein, das Medikament abzusetzen. Auch manche Antibiotika (z. B. die sogenannten Tetrazykline) können einen erhöhten Hirndruck bewirken. Sie sollen deshalb nach Möglichkeit nicht mit einem Retinoid kombiniert werden.
Gelegentlich kann es unter Neotigason zu „muskelkaterähnlichen“ Beschwerden kommen, die sich aber meist nach Dosisreduzierung oder auch spontan wieder zurückbilden. Auch ein rückbildungsfähiger Haarausfall wird nach länger andauernder Behandlung – nach unserer Erfahrung besonders häufig bei Frauen – beobachtet. Er ist aber meistens nicht wirklich schlimm. Ab und zu sieht man auch, dass sich die Haut an Händen und Füßen verstärkt abschält.
Wesentlich ernster zu nehmen ist, dass es unter Retinoiden sehr gelegentlich zu Stimmungsschwankungen (Depressionen) kommen kann, die nach unserer Erfahrung aber eher bei dem verwandten Präparat Isotretinoin auftreten und die wir persönlich bei Patienten mit Ichthyosen oder Psoriasis in Bezug auf Neotigason noch nicht gesehen haben.
Wir beobachten, dass Neotigason von den Patienten sehr unterschiedlich aufgenommen (resorbiert) wird, so dass die notwendige Dosis, um einen zufriedenstellenden Effekt zu erzielen, individuell sehr unterschiedlich ist.
Ein großes Problem bei der Therapie mit Neotigason stellt die Schwangerschaft dar, da das Präparat absolut fruchtschädigend ist und man unter dieser Therapie nicht schwanger werden darf. Da sich das Präparat auch im Fettgewebe anreichern kann, müssen Frauen auch nach Absetzen von Neotigason noch 3 Jahre (!) auf eine Schwangerschaft verzichten. Dies führt dazu, dass man bei Frauen und weiblichen Teenagern besonders zurückhaltend mit dem Einsatz von Neotigason ist. Ein Ausweichpräparat stellt hier aber das Retinoid Isotretinoin dar.
Acicutan (Neotigason®) und das Skelett
Wenn das Präparat Neotigason® über viele Jahre (5 und mehr Jahre) gegeben wird, sind Kontrollen der Wirbelsäule erforderlich, um sogenannte Hyperostosen, d. h. Verkalkungen z. B. im Bereich des Bandapparates der Wirbelsäule als auch an Knochen auszuschließen. Allerdings ist der Krankheitswert der Hyperostosen nicht ganz klar, da viele ältere Menschen auch ohne eine Neotigason-Behandlung solche Hyperostosen entwickeln. Im ungünstigen Fall kann die Beweglichkeit z. B. im Rücken eingeschränkt werden. Nach meiner persönlichen Erfahrung entwickeln viele ältere Ichthyose-Patienten solche Probleme bei Langzeittherapie. Diese Probleme können bei älteren Menschen aber genauso gut ohne eine Retinoid-Therapie auftreten. Solange keine eindeutige Symptomatik besteht, ist der Abbruch einer Retinoid-Therapie bei Nachweis von Hyperostosen nicht zwingend.
Der zunächst sehr gute Erfolg einer Neotigason-Therapie kann bei vielen Patienten auf Dauer nicht in gleicher Weise aufrechterhalten werden. Trotzdem kann die Retinoid-Therapie für das Alltagsleben eine enorme Erleichterung bedeuten.
Zusammenfassend lässt sich sagen: Wir halten die Gabe von Neotigason nach sorgfältiger Abwägung für sinnvoll und nach wie vor für vertretbar, auch über lange Zeiträume wie 10 oder 20 Jahre hinweg. Der Einsatz muss im Einzelfall sorgfältig abgewogen und auch auf Dauer überwacht werden.
Neotigason® und Kinder
Neotigason® (Wirkstoff Acicutan) ist auch für den Einsatz im Kindes- und Jugendalter zugelassen. Hier muss man sich aber darüber im Klaren sein, dass Nebenwirkungen auf die Ausreifung der Wachstumsfugen der Knochen nicht wirklich vorhersagbar sind und zunächst sogar unbemerkt auftreten können. In der Literatur gibt es dazu nur wenige Mitteilungen, die zudem Patienten betreffen, die relativ hoch dosiert behandelt worden sind. Mir persönlich hat ein Betroffener, den wir in Münster als Jugendlichen für mehrere Jahre mit einer mittleren Dosis von Neotigason® behandelt haben, berichtet, dass es bei ihm zu einem asymmetrischen Auswachsen der Beine und zu einer Beinlängendifferenz von 2,5 cm gekommen ist. Er trägt deswegen besonderes Schuhwerk. Wir vermuten, dass es sich hierbei letztlich doch um eine unerwünschte Nebenwirkung der seinerzeit durchgeführten Neotigason-Therapie handelt. Wir sind deshalb inzwischen bei dem Einsatz von Neotigason bei Jugendlichen und Kindern recht zurückhaltend geworden, sind uns aber auch bewusst, dass insbesondere bei den vielfältigen Problemen in der Pubertät die Neotigason-Therapie für die Jugendlichen einen Segen darstellen kann. Wir halten die Gabe von Neotigason bei Harlekin-Ichthyose für vertretbar und sinnvoll und empfehlen ansonsten, mit der Acitretingabe erst nach dem 16. Lebensjahr zu beginnen. In europäischen Nachbarländern wie Frankreich oder dem UK sieht man das zumeist „lockerer“. Anzumerken ist, dass die Dosierung des Medikamentes bezüglich der möglichen Nebenwirkungen natürlich eine entscheidende Rolle spielt und wir heutzutage niedrigere und vorsichtigere Dosierungen wählen.
3.3 Biologics
Bei der Schuppenflechte und Neurodermitis feiern die sogenannten Biologics seit einigen Jahren große Therapieerfolge. Bei Ichthyose sehen wir oft eine begleitende entzündliche Komponente ähnlich wie bei einer Schuppenflechte oder Neurodermitis. In diesen Fällen haben wir bereits Biologics eingesetzt; und es besteht die Aussicht auf eine klinische Studie für entzündliche Ichthyosen, die in Zentren in Berlin, Rostock und Münster stattfinden könnte. Wir haben in Einzelfällen bei Ichthyose teilweise sehr gute Effekte bei dem einen und anderen Biologicum beobachtet und sind daher froh, dass es in diesem Gebiet neue Forschungsaktivität gibt. Wir müssen die Frage beantworten, welches Biologicum bei welcher Form der Ichthyose eingesetzt werden kann, und die Sicherheit der Behandlung wird genau überwacht. Bei Psoriasis z. B. setzen sich manche Betroffene daheim alle 1-3 Monate eine subkutane Injektion und lassen die allgemeinen Blutwerte alle 3 Monate überprüfen.
Danksagung
Wir danken unseren Patienten für ihre Mitarbeit und Rück-Koppelung. Insbesondere der Erfahrungsaustausch mit dem Selbsthilfe Ichthyosis e.V. ist für uns immer wichtig. Die wissenschaftlichen Arbeiten von Prof. Heiko Traupe zur Thematik der Ichthyosen wurden vom Bundesministerium für Bildung und Forschung (BMBF) im Rahmen des Förderschwerpunktes des BMBF Netzwerkes für seltene Erkrankungen GFGM01143901 von 2003 bis 2013 gefördert, hier der Förderung des Netzwerkes für Ichthyosen und verwandte Verhornungsstörungen, von der Deutschen Forschungsgemeinschaft (DFG TR228/6-2) und vom Selbsthilfe Ichthyose e.V. Besonders dankbar bin ich der SI und UFFI für die aktuelle Förderung der Forschung zur Enzym-Creme bei Transglutaminase-1 Mangel bedingter ARCI (lamellärer Ichthyosis) die auch nach meinem Ruhestand an der Münsteraner Klinik weiter durchgeführt wird.
Post scriptum
Gerne können Sie mir (Heiko Traupe) auch eine E-Mail schicken mit einer persönlichen Frage. Bitte bedenken sie dabei, dass ich mich inzwischen im Ruhestand befinde und die Hautklinik oft nur einmal die Woche aufsuche. Mein Ko-Autor, Herr Privatdozent Dr. Vinzenz Oji führt zurzeit gemeinsam mit Frau Dr. Kira Süßmuth einmal die Woche die Ichthyosis-Sprechstunde an der Münsteraner Klinik durch und ist ansonsten als Hautarzt mit eigener Praxis in Münster niedergelassen. Als weitere klinische Ansprechpartnerin steht in Münster Frau Dr. Kira Süßmuth zur Verfügung. In wissenschaftlicher Hinsicht beschäftigt sie sich unter anderem mit den feingeweblichen Mustern (histologische pattern-Diagnostik) der Ichthyosen.



